近几年,市场上逐渐兴起各种干细胞疗法,然而真正获批的干细胞产品有多少?与火热市场形成对比的是,今年1月,我国首款干细胞治疗药品才获批上市。国家药监局通过优先审评审批程序附条件批准艾米迈托赛注射液上市,用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病。
为何我国首款获批干细胞药品姗姗来迟?为何干细胞药品和技术迟迟难以落地应用?干细胞从科研到市场应用还有多远?
干细胞应用前景及发展现状
干细胞具有自我更新、自我复制能力,并且能够分化形成体内多种功能细胞,是维持机体正常运行的重要细胞类型。干细胞在免疫调节、组织修复和抗炎方面有广阔发展前景,未来,人类可以通过补充外源干细胞来治疗疾病,战胜传统手术或化学药物无法解决的问题。
目前,在临床试验中应用较多的干细胞类型包括间充质干细胞、神经干细胞、胚胎干细胞和诱导多能干细胞等,主要来源为脐带、脂肪、骨髓、皮肤等组织。
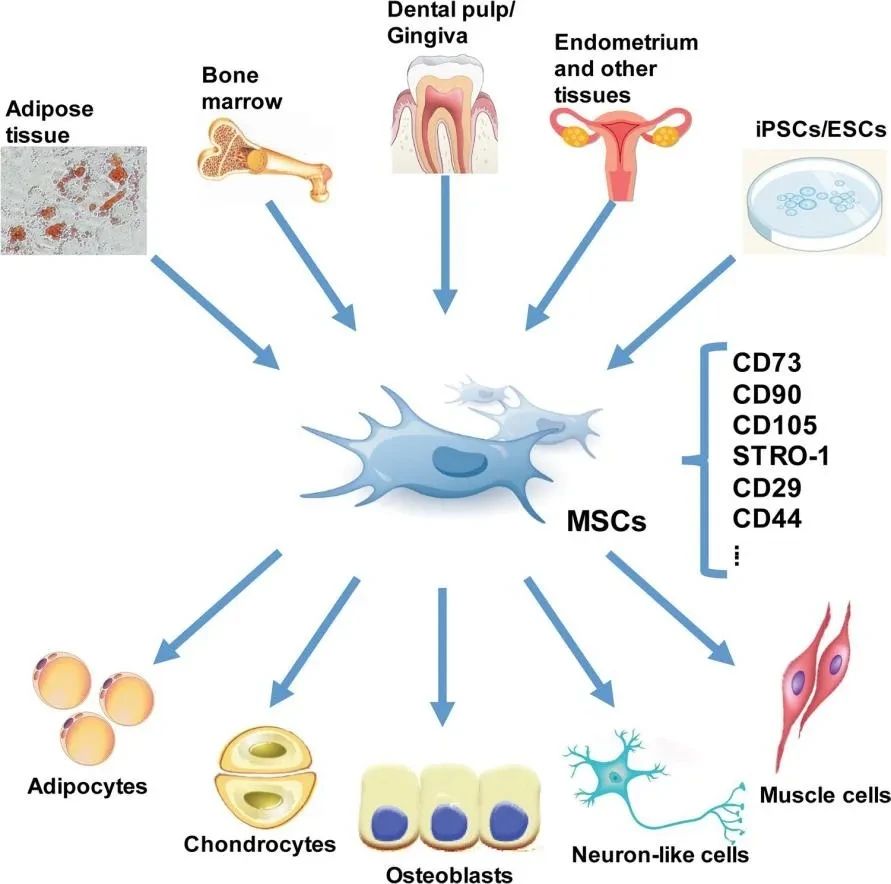
根据CDE官网最新数据,截至2025年3月,我国共受理了160例干细胞药物临床试验申请,其中120款获准默许进入临床试验(临床试验默示许可)。其中,间充质干细胞药物,占比70%以上,是干细胞药物研发主要的细胞类型。
目前,我国在干细胞临床研究及转化应用方面采取“双轨制”:一是药物路线,企业完成动物实验后,条件符合者可以向国家药监局申请开展临床试验;二是技术路线,医疗机构向国家卫健委申请备案并获批后,方可开展临床研究。
干细胞从科研到转化的瓶颈
我国干细胞发展仍处于0到1的初级阶段,从基础研究来看,中国发表论文和专利的数量在国际上仅次于美国;但在转化应用方面,中国进入临床研究的项目占比不高,尤其是进入二期、三期临床的比例更低。
干细胞的转化瓶颈主要集中在三个方面:首先是我国干细胞研究起步较晚;其次细胞药物本身就比传统药物更加复杂、特殊,因而其审批路径不同,各国监管部门对活的细胞药物的监管法案也仍在不断完善中;再者干细胞生产制备相当复杂、需要克服的困难也就更多。
一些企业虽成功通过干细胞药物的审批,但因单批次细胞数量不足以满足临床试验需要,无法开展全程临床试验,若更换细胞批次又需重新申报。此外,大多数医院临床研究需要从企业采购细胞,若企业提供的不是同一批次的新鲜细胞,临床结果难以重复,难以形成大样本的临床研究资料和疗效判定。
友康无血清体系助力干细胞应用转化
友康生物作为国内领先的细胞治疗用无血清细胞培养基的研发生产企业,长期致力于干细胞领域的研究,自2012年就进入该市场,凭借着数十年的积累和无数的成功经验,已经形成了针对MSC和IPSC的干细胞无血清培养产品线,产品批次稳定,性能不输进口品牌,支持干细胞的大规模培养,目前已与多家药企在中国和美国开展干细胞药品的联合申报,实现应用转化。友康能为从事MSC和IPSC产品开发的企业与科研单位,提供高品质、成本可控且产品线完整的可靠供应链支持,助力推动干细胞行业的应用转化。
友康生物 MSC全线产品列表

友康生物 iPSC全线产品列表
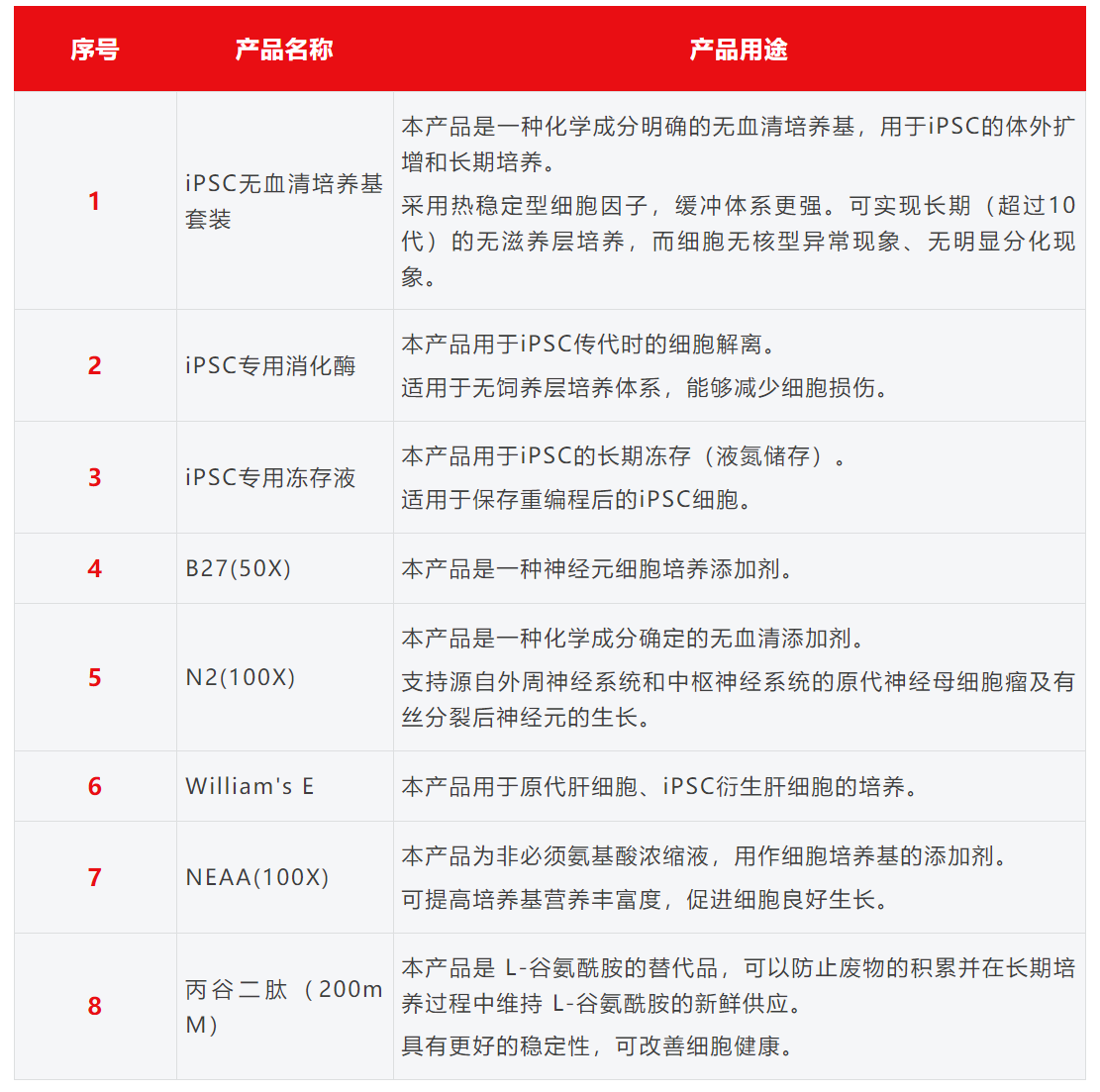
目前细胞治疗无论科研还是产品制备质控使用的仪器、设备、试剂、耗材和软件等大部分都是国外进口,并且价格昂贵。这种长期依赖进口的情况,在目前的国际形势下给供应链安全带来较大风险,设备试剂耗材等国产化替代刻不容缓。友康生物无血清培养基系列产品性能不输国外品牌,获得众多业内标杆客户认可。供应链稳定,完全满足生物药客户商业化生产和对原料的安全性、稳定、合规、有效等全方位需求。

联系友康了解更多产品信息

 友康生物
友康生物 2025-05-12
2025-05-12 公司热点
公司热点



